*仅供医学专业人士阅读参考靠谱配
乳腺X线影像的微钙化与HER2阳性显著相关
乳腺癌是全球女性死亡的主要原因之一[1]。尽管在筛查、早期检测和个性化治疗方面取得了显著进展,但乳腺癌的高度生物学异质性仍带来了不小挑战。乳腺X线摄影是乳腺癌的重要筛查工具之一,其中微钙化(MCs)是最常见的发现之一[2]。尽管MCs的存在与特定乳腺癌分子亚型之间的潜在关联逐渐引起学界的兴趣,但现有文献证据仍然有限。值得注意的是,有研究发现HER2阳性乳腺肿瘤中MCs的发生率更高[3]。然而,目前尚缺乏通过多变量队列分析进行彻底评估的相关证据。
针对以上背景,近期一项回顾性研究展开了深入分析,旨在评估浸润性乳腺癌人群中MCs是否与HER2阳性独立相关[4]。本文特此整理关键信息,供读者参考。

图1 研究标题
研究方法
研究人群及分类
研究基于2018年1月至2023年12月期间连续收治的浸润性乳腺癌患者队列开展,共纳入283例经组织学确诊为浸润性乳腺癌的女性。排除了诊断为原位癌无浸润成分、同时性双侧、局部复发以及数据不完整的病例。
乳腺X线摄影发现根据乳腺影像报告和数据系统(BI-RADS)进行分类,BI-RADS 4类或5类的发现均进行活检以获取组织样本并确定病变性质。MCs的存在由经验丰富的乳腺放射科医生在乳腺X线摄影报告中系统评估。乳腺密度分类使用半定量评分评估无癌乳腺的密度,并采用类似于BI-RADS分类的方法,按密度百分比汇总为四类:A类 ≤25%;B类 25–50%;C类 50–75%;D类 75–100%。
免疫组织化学(IHC)分析提供了关于雌激素受体(ER)、孕激素受体(PR)、HER2表达的数据。根据HER2表达状态靠谱配,患者被分为HER2阳性组(55例)和HER2阴性组(130例)。根据ER、PR和HER2表达,肿瘤被分为五种免疫表型:(1) Luminal A型;(2) Luminal B型HER2阴性;(3) Luminal B型HER2阳性;(4) HER2富集型; (5) 三阴性(TN)。
统计分析
使用描述性统计描述研究人群的临床、影像学和病理学特征。分类变量以绝对频数和百分比表示,并酌情使用卡方检验或Fisher精确检验进行比较。连续变量根据分布报告为均值±标准差或中位数及四分位数范围,并使用Student t检验或Mann–Whitney检验进行比较。
为识别乳腺X线MCs存在的独立预测因素,应用了二元逻辑回归模型。因变量是MCs的存在(是/否)。独立变量包括:HER2状态(阳性/阴性)、年龄(>50岁 vs. ≤50岁)、乳腺密度(ACR C和D vs. A和B)、组织学类型(IDC vs. 其他)和分子亚型(Luminal B HER2+)。随后,将单变量分析中p<0.10的变量纳入多变量模型,结果报告为调整后的比值比(aORs)及其95%置信区间(95%CIs)。双侧p值<0.05被认为具有统计学显著性。
研究结果
最终分析队列共纳入185例符合所有纳入标准的女性,其临床特征如表1所示。其中仅有55例(29.7%)女性为HER2阳性肿瘤,130例(70.3%)为HER2阴性肿瘤。诊断时的患者中位年龄为61.3岁(范围36-85岁),其中154例患者(82.3%)年龄大于50岁。
表1 患者基线特征

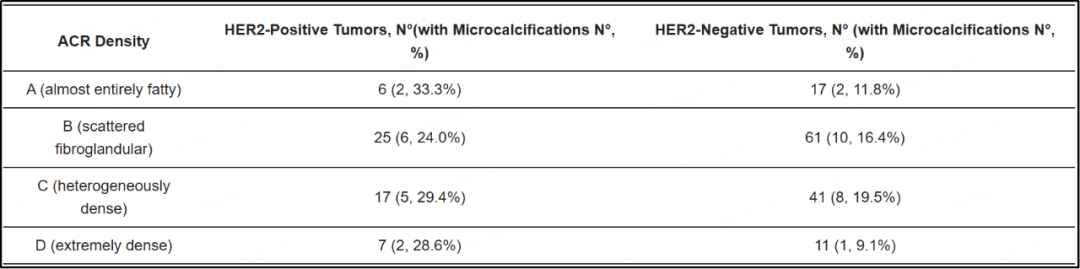
根据ACR分类的乳腺密度分布如下:A类(12%)、B类(45.9%)、C类(31.4%)和D类(9.7%)。对四个BI-RADS密度类别(ACR A-D)中MCs存在情况的分析显示,组间无显著差异。MCs在ACR A类肿瘤中的出现概率为17.4%(4/23),ACR B类中为18.6%(16/86),在ACR C类中为22.4%(13/58),在ACR D类中为16.7%(3/18)(卡方检验,p=0.92)(表2)。因此,作为四水平变量考虑的乳腺密度与乳腺X线影像上MCs的存在无显著关联。
值得注意的是,在所有密度亚组中,均一致观察到HER2阳性肿瘤的MCs患病率更高。在每个ACR类别中,HER2阳性肿瘤比HER2阴性肿瘤更频繁地表现出MCs(例如,ACR A类中为33.3% vs 11.8%;见表2)。然而,由于每个亚组的样本量有限,这些类别内的差异未达到统计学显著性。
表2 MCs与BI-RADS乳房密度(ACR类别A-D)和HER2状态的数据分析靠谱配
当乳腺密度被分类(ACR A至D)或二分(A-B 对 C-D)评估时,在任一模型中均未发现其与MCs存在具有统计学显著关联。这表明,在本研究队列中,密度本身并非此影像学特征的独立预测因素。关于组织学类型,68例(37%)为浸润性导管癌(IDC),32例(17.3%)为IDC伴导管原位癌(DCIS),17例(9.2%)为浸润性小叶癌(ILC),5例(3%)为ILC伴小叶原位癌(LCIS),63例(34%)为其他类型。此外,最具代表性的分子亚型是Luminal A型(68%),其次是非Luminal HER2阳性型(19.5%)、Luminal B HER2阳性型(10%)和三阴性型(2%)。
共有36例患者(19.5%)经乳腺X线摄影观察到MCs,患者分布如下:HER2阳性组:15/55 (27.3%),HER2阴性组:21/130 (16.15%)。差异具有统计学显著性(p<0.001)。
表3 根据乳腺癌分子亚型的MCs分布

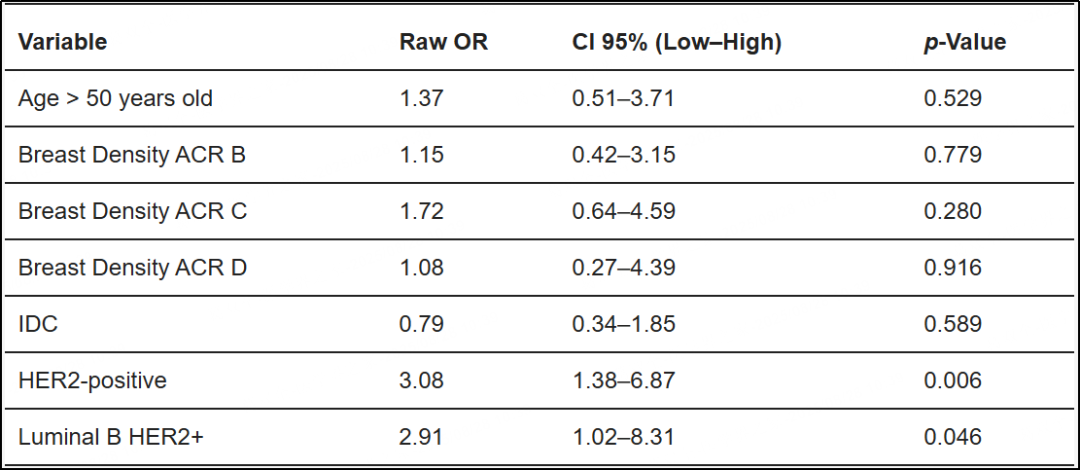
单变量分析中显示(表4),HER2阳性状态(OR=3.08;95%CI,1.38–6.87;p=0.006)和Luminal B HER2阳性亚型(OR=2.91;95%CI,1.02–8.31;p=0.046)与MCs的存在显著相关。其他临床-放射学变量,包括年龄>50岁、乳腺密度(ACR B、C、D)和浸润性导管癌(IDC)组织学,均未显示出统计学显著关联。
表4 单变量分析:临床放射学变量与MCs存在之间的关联
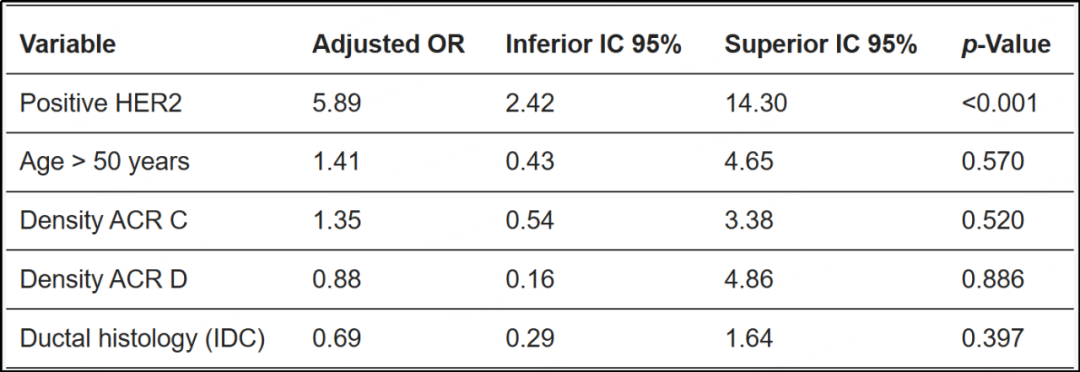
多变量分析显示,只有HER2阳性状态与MCs的存在显著相关,调整后的比值比(aOR)为5.89(95%CI,2.42–14.30;p<0.001)。其他变量(年龄>50岁、ACR C或D类乳腺密度、IDC组织学)均未显示统计学显著性(表5)。
表5 多变量分析(逻辑回归):MCs的独立预测因子
文章小结
本研究证实,乳腺X线摄影上的MCs与HER2阳性乳腺癌存在显著关联,且该关联不受乳腺密度影响。MCs不仅可能是HER2阳性肿瘤的影像学标志,更可能反映了其活跃的生物学特性,如诱导钙化的能力。这一发现强化了MCs在临床实践中的价值,或许可作为早期筛查中提示HER2阳性的预警信号,从而指导尽早进行分子分型并制定靶向抗HER2治疗策略。尽管本研究为单中心回顾性分析存在一定局限性,但结果凸显了整合影像学表型与分子生物学信息在实现乳腺癌精准诊断与个性化管理方面的重要性。
参考文献:
[1]Arnold M, et al. Current and future burden of breast cancer: Global statistics for 2020 and 2040. Breast. 2022 Dec;66:15-23.
[2]Tot T, et al. The clinical value of detecting microcalcifications on a mammogram. Semin Cancer Biol. 2021;72:165-174.
[3]Cen D, et al. BI-RADS 3-5 microcalcifications can preoperatively predict breast cancer HER2 and Luminal a molecular subtype. Oncotarget. 2017;8(8):13855-13862.
[4]Boemi S, et al. Imaging Biomarkers for HER2-Positive Breast Cancer: Evidence from an Observational Study. J Clin Med. 2025;14(14):5056. Published 2025 Jul 17.
本材料由阿斯利康提供,仅供医疗卫生专业人士参考
审批编号:CN-170641 过期日期:2026-10-30
*此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场。
瑞和网提示:文章来自网络,不代表本站观点。